—— 企业新闻 ——
凯瑞德医药新创药介绍
发布时间:2024-06-13 /} 浏览次:数
一、新创药概况
药品名称:伏诺拉生片
适应症:反流性食管炎。“重磅炸弹级”药物,K+竞争性酸阻滞剂(P-CAB)
原研单位:日本武田制药(Takeda),2019年进口
市场前景:2015年2月日本上市开始,陆续在包括中国美国这样的大的市场上市;近年来连续多年入选全球销售额TOP200小分子药物排行榜。
医保情况:2020年底,该产品通过谈判成功进入国家医保乙类目录。
产品研发进度:中试阶段,解决了全球公认的难题
产品难题:亚硝胺杂质超标
事件背景:
2022年8月,Phathom公司宣布发现在商业批次中存在微量的亚硝胺杂质N-亚硝基-伏诺拉生(N-nitroso-vonoprazan,NVP)。2023年1月,Phathom公司说明该公司正在与FDA合作,以获得拟议的可接受每日摄入量限值、检测方法和质控批准。FDA将NVP的可接受每日摄入量限制定为96 ng/天,但FDA要求提供额外的稳定性数据,以证明在产品的拟议保质期内其NVP水平始终低于该限值。因亚硝胺杂质问题,FDA暂缓批准伏诺拉生上市。2023年5月23日,Phathom微改制剂配方,以减缓亚硝杂质的增长,重新提交了伏诺拉生的NDA。2023年11月,Phathom公司宣布FDA批准VOQUEZNA®伏诺拉生片剂用于治疗糜烂性食管炎和缓解成人糜烂性食管炎相关胃灼热。
遗留问题
总结伏诺拉生在美国上市申请遇到的亚硝胺杂质问题,有几点值得注意。伏诺拉生亚硝胺杂质目前仍未纳入FDA和EMA的药物相关亚硝胺杂质列表。需要指出的是通过伏诺拉生分析结构以Carcinogenic Potency Categorisation Approach(CPCA)评估每日摄入量限值,伏诺拉生应属于CPCA分类1类,对应AI值FDA为26.5ng/天,EMA为18ng/天。FDA目前给出的96ng/天不确定是否为临时限度。Phathom公司公告还表明FDA会要求亚硝胺在制剂中的长期数据。Phathom公司通过小改制剂配方后才满足FDA的额外的稳定性数据要求,并将亚硝胺杂质控制在极低水平。
二、凯瑞德医药新创药难点及研发特点介绍
1、伏诺拉生亚硝胺杂质特征测绘
为解决申报过程中伏诺拉生制剂中的亚硝胺杂质问题。我公司通过伏诺拉生原料药亚硝化反应合成了高纯度的N-亚硝基-伏诺拉生(N-nitroso-vonoprazan,NVP)。其核磁氢谱如下图1。
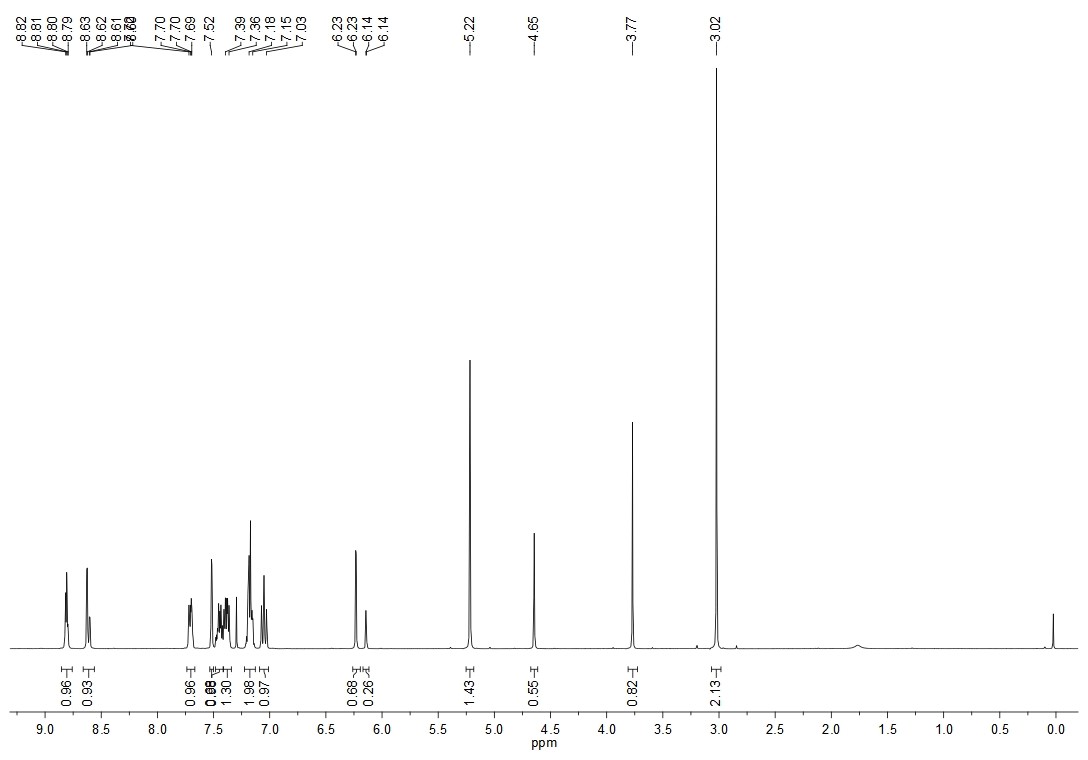
图1:N-亚硝基-伏诺拉生的核磁氢谱(CDCl3)
我们发现伏诺拉生的甲基氢(δ: 3.02, 3.77)、亚甲基氢(δ: 4.65, 5.22)和吡咯环上一个氢(6.23,6.14)受到附近N-亚硝基的影响,均明显分为两组,积分比约为2.6:1。不仅如此,亚硝胺化合物在液相也可能出现双峰的现象。这种现象可解释为亚硝胺化合物存在类似于烯烃的顺反异构现象,如下图2。这给分析定性和定量方面的工作带来了挑战。凯瑞德医药积累了丰富的亚硝胺杂质研究经验,能很好的为客户解决药物申报过程中亚硝胺杂质研究的相关问题。
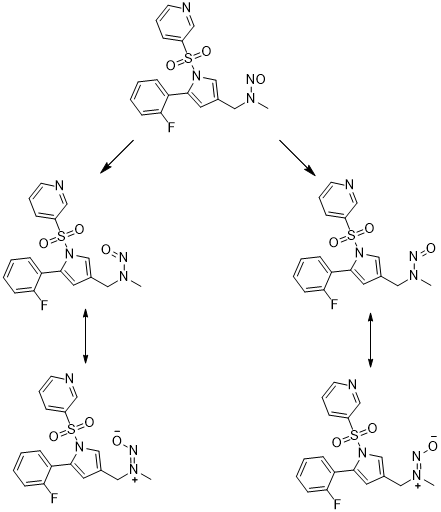
图2:N-亚硝基-伏诺拉生存在的顺反异构现象
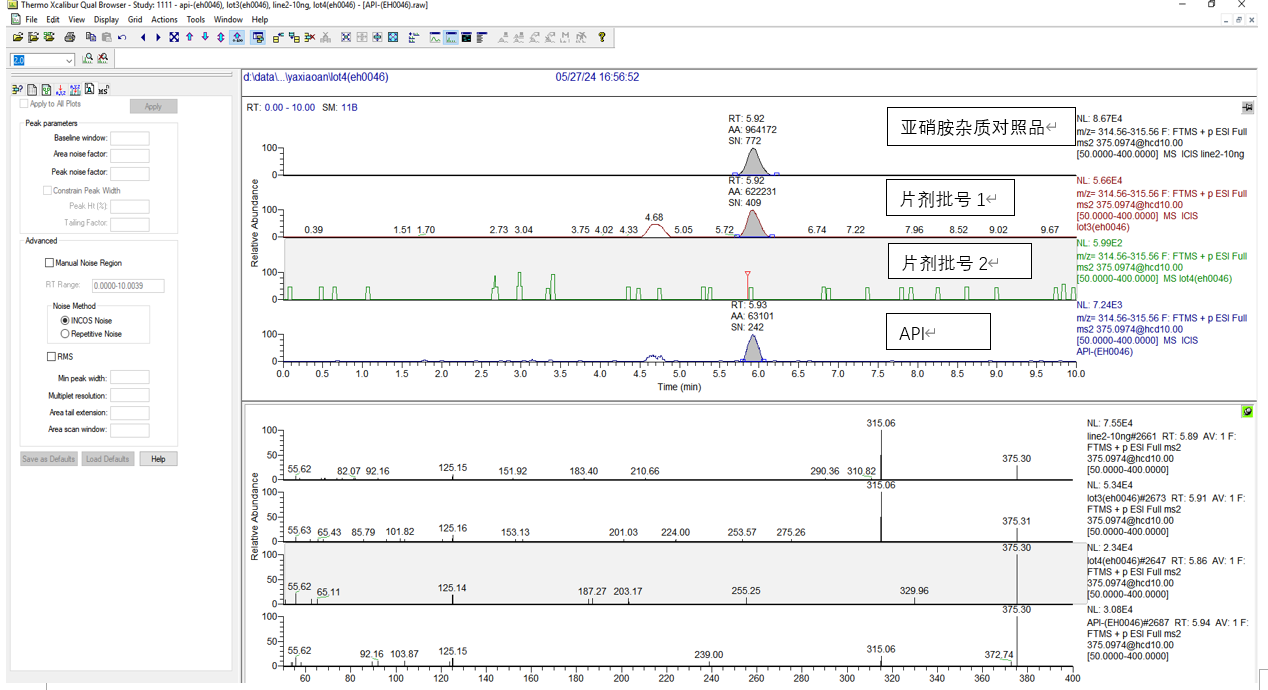
2. 中试批次和其它市售批次比较
可以看出 亚硝胺杂质可以降低到检出限以下
凯瑞德医药作为国内较早进行药物制剂研发技术输出以及ICH国家药品上市服务的公司,自2008年成立至今,一直秉承“客户至上”的理念,现已发展成为具有百人研发团队,同时配备占地超5000平研究实验中心的大型CRO公司,为了快速高效的完成客户交付的任务,凯瑞德配备多种基础和前沿研发设备,打造“新的注册技术及研究平台”,可保证在进行国内药品申报的同时符合国际规范要求,实验室体系执行OMCL标准,可接受海外官方核查。技术开发模式包括从产品立项、处方设计、处方优化、中试放大、临床研究/BE等服务内容。



